球磨工ブログ
カテゴリ:学校風景
化学基礎
3月に入り、化学基礎の授業は「酸化還元反応」に入りました。
座学半分、実験半分で授業を進めていますが、残りの授業が少なく、全クラス均一には終われそうにありません。7日(金)には1つのクラスが今年度最後の化学基礎の授業を終えました。
座学半分、実験半分で授業を進めていますが、残りの授業が少なく、全クラス均一には終われそうにありません。7日(金)には1つのクラスが今年度最後の化学基礎の授業を終えました。
実験15 酸化還元反応1
酸素、水素、電子のやりとりや、酸化数の増減など酸化還元の定義について説明を受け、酸化と還元が同時に起こることなどを学習しました。
また、さらに金属のイオン化傾向も学習し、金属にも反応しやすいものとしにくいものがあることを理解しました。
1つ目の実験は、マグネシウムの燃焼

炎を上げて燃えるほど、反応しやすい金属ということ、金属のイオン化傾向の大きな金属ということを知ることができる実験です。
2つ目の実験は、銅の酸化


ガスバーナーで熱した導線が空気に触れると酸化されて黒色の酸化銅(II)に変化します。
銅は金属のイオン化傾向の小さな金属です。(反応しにくい金属です。)そのため、古くから硬貨などに使用されています。
3つ目の実験は、酸化銅(II)の還元です。


CuO → Cu 酸化銅(II)は還元されて赤銅色の銅になります。
(酸素が失われるから、還元です。)
CH3OH → HCHO メタノールは酸化されてホルムアルデヒドになります。
(水素が失われるから、酸化です。)
この反応では、酸化銅(II)が酸化剤(相手を酸化する物質)、メタノールが還元剤(相手を還元する物質)の役割を果たしています。
桃や梅など
管理棟の改築などに伴い、校内の樹木も整備され、花の咲く樹木は数が減りました。
体育館近くのモモ(桃)はもう散り始めています。今年の花は小振りのような気がします。


北門の坂の2本のミザクラ(実桜)は校内で一番早く咲くサクラです。5月上旬にサクランボがなります。


北門の坂のカンヒザクラ(寒緋桜)はまもなく開花。


ソメイヨシノ(染井吉野)はまだまだ開花は遠いようです。ほのかにつぼみが色付いてきました。


赤>白の源平咲きのウメ(梅)は正門近くにあります。


最期にプランターのチューリップ。がんばれチューリップ春は近いぞ。

化学基礎
学年末考査が終了し、授業の残りもわずかとなりました。
今週の実験は中和滴定でした。
今週の実験は中和滴定でした。
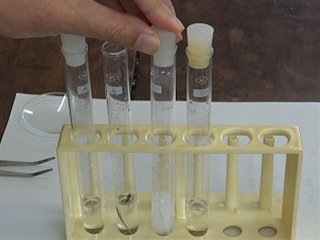
実験14 中和滴定
中和滴定は、酸や塩基の水溶液の濃度を決定する大切な実験です。
まずは、この実験に欠かせない、4つの器具の紹介から授業を始めました。
写真は、ホールピペットとメスフラスコです。ホールピペットは、一定の体積の溶液を取る器具で、メスフラスコは固体や液体を一定の体積に薄める器具です。


次は、コニカルビーカーとビュレットです。ビュレットから塩基の水溶液を滴下し、コニカルビーカー中の酸の水溶液を中和します。ビュレットは目盛りがあり、入れた溶液の体積を知ることができます。コニカルビーカーは普通のビーカーよりやや口が狭くなっていて、振り混ぜても液がこぼれにくい形になっています。


今回の実験では食酢中の酢酸の濃度を決定します。
まずは、ホールピペットとメスフラスコを使い、食酢を正確に10倍に薄めます。10倍に薄めた食酢を10mLホールピペットでコニカルビーカーに取ります。本実験では、ここまでの操作を教員側で行いました。
生徒はビュレットを操作して、中和を行い、滴下量から食酢中の酢酸の濃度を計算します。
10倍に薄めた食酢にフェノールフタレイン溶液を1滴加えます。次に、ビュレットの目盛りを読みます。最小目盛りの10分の1まで目分量で読み取るのは常識です。写真のビュレットの液面を、私は8.28mLと読み取りました。


ビュレットを操作して、慎重に0.100mol/L水酸化ナトリウム水溶液を滴下し、混ぜても淡い赤色が消えなくなったときが中和完了です。


中和が終わったときのビュレットの目盛りは、15.31mLと読み取りました。ちなみに数滴加えすぎただけで、溶液は赤くなりました。


15.31-8.28=7.03mLと滴下量を計算できました。このような中和を3回ほど繰り返し、滴下量の平均値を求めるのですが、ここでは、7.03mLを平均値として濃度の計算を行います。
「酸の価数×酸のモル濃度×酸の体積=塩基の価数×塩基のモル濃度×塩基の体積」の式を用いて、10倍に薄めた食酢のモル濃度を求めます。
1×酸のモル濃度×10=1×0.100×7.03 酸のモル濃度=0.0703mol/L
元の食酢のモル濃度は10倍になるので、0.703mol/L
1L=1000mLの食酢の密度を1g/mLとすると、1000mL×1g/mL=1000g
1Lの食酢に含まれる酢酸(分子量60)は、0.703mol×60g/mol=42.18g
(42.18g÷1000g)×100=4.218% 四捨五入して、4.22%と計算できました。
食酢のラベルには酸度4.2%とあるので、実験成功と言えると思います。

操作の難しい実験ですが、淡い赤色になり、きちんと中和できた班が多かったです。しかし、目盛りの読み取りミスや、計算ミスなどがあり、食酢中の酢酸の濃度がおかしい結果もありました。




化学基礎
考査前の2月上旬、酸・塩基の指示薬の実験を行いました。
実験13 酸・塩基の指示薬
メチルオレンジ、フェノールフタレインがどの程度のpHで変化するかを観察する実験と中和反応中のBTBの色の変化を見る実験です。
pH1の塩酸10mL、水9mL×5を準備し、すべてにメチルオレンジを加えます。
塩酸を1mL取って、水9mLに加え、10倍に薄めます。さらに10倍に薄めた塩酸を1mL取って、水9mLに加え、10倍に薄めます。この操作を繰り返して、どんどん10倍ずつ薄めていきます。


pH1の塩酸は10倍に薄めるとpH2の塩酸になります。pH2の塩酸は10倍に薄めるとpH3の塩酸になります。pHが1異なると濃度は10倍違います。
メチルオレンジは酸性側で赤色、塩基性側で黄色となりますが、中性のpH7ではなく、pH4程度で色が変わることが分かります。
次はpH13の水酸化ナトリウム水溶液10mL、水9mL×5を準備し、すべてにフェノールフタレイン溶液を加え、同じように実験します。

pH13の水酸化ナトリウム水溶液を10倍に薄めるとpH12に、さらに10倍に薄めるとpH11になります。酸も塩基も薄めることにより、pH7の中性に近づいていきますが、いくら薄めてもpH7の中性にはなりません。酸はいくら薄めても酸です。塩基はいくら薄めても塩基です。
フェノールフタレインはpH10付近で変色することが分かります。(教科書などではpH9付近で変色する様子が掲載されていますが、空気中の二酸化炭素の影響で少しずれるようです。)フェノールフタレインは酸性側で無色、塩基性側で赤色となります。
最後にBTB(ブロモチモールブルー)の変色です。
試験管に水3~5mL、0.1mol/Lの塩酸10滴、BTB3滴を加えよく混ぜた後で、0.1mol/L水酸化ナトリウム水溶液を1滴ずつ加え、色の変化を見ます。




同じ濃度の塩酸と水酸化ナトリウム水溶液ですので、10滴ずつでちょうど中和するはずですが、そのためには1滴のサイズも同じにしないといけないので、ちょうど中和することは難しいです。
BTBは酸性側で黄色、中性付近で緑色、塩基性側で青色になります。
リトマス、BTB、フェノールフタレイン、メチルオレンジの4種類のpH指示薬とその色の変化は覚えてください。
と言ったのですが、学年末考査の結果は・・・。教え方が悪かったようですね。球磨工に来て6年間、まさかこんな低い平均点を見ることになるとは・・・。
就職・進学は3年生でがんばればよいというものではありませんよ。1年の成績もしっかり影響します。さらに、就職・進学では全国の高校生と比較されることになります。
もう、競争は始まっていますよ。
くまもとアートポリスプロジェクト見学会
2月23日(日)14:00~15:00に、管理棟と加工組立室棟の見学会が行われ、外部から多くの方が来校されました。
くまもとアートポリスプロジェクト見学会様のバスの到着です。


まずは、管理棟の見学です。






セントラルパークを通り、加工組立室棟へ移動です。


加工組立室棟の見学でも写真をたくさん撮られていました。


お帰りの寸前まで、管理棟の外観を見る方もおられ、よい見学会になったようでした。


2年生列車通学生清掃活動
学年末考査終了後、13~14時に人吉駅とひよどり越えの清掃が行われました。
年3回行っている清掃活動ですが、今回は2年生列車通学生が行いました。






清掃は真面目に行われていたのですが、生徒も私も気になったのが、3月15日より運行開始の新型車両「田園シンフォニー」で、試運転でホームに来ていました。(一般車両としての運行は3月8日からのようで、運行開始セレモニーもあるそうです。)




三両編成で、赤色の車両が「秋」、茶色の車両が「冬」、ベージュ色の車両が「春」となっていますが、「夏」はどこに?御存知の方、教えてください。
追記
来年度、青色の「夏」と白色の「朝霧」が納車される予定だそうです。
化学基礎
修学旅行、前期選抜などがあり、あまり授業が進んでいません。
でも、実験しない化学の授業はありえません。ということで、修学旅行後に実験しました。
でも、実験しない化学の授業はありえません。ということで、修学旅行後に実験しました。
実験12 酸・塩基の強弱
4本の試験管に入った塩酸、酢酸、水酸化ナトリウム水溶液、アンモニア水を判別する実験です。
まずは、においから。どの溶液も同じモル濃度ですが、十分に薄めてあるため、ほとんどの班が酢酸しか判断することができません。数名の生徒はアンモニア水を嗅ぎ分けました。よい鼻の持ち主です。
(経験上の話となりますが、酢酸はかなり希釈してもにおいが分かりますが、アンモニアはある程度希釈するとにおいが分かりにくくなります。)
次は、リトマス紙で酸性かアルカリ性かを判断します。
溶液をガラス棒につけ、赤と青のリトマス紙につけて変化を見ます。




次は万能指示薬で溶液のpHを調べます。pH7は中性、7より小さいと酸性、7より大きいと塩基性(アルカリ性)です。




pHを決定したことで、4種類の溶液が何であるか判断できました。
pHの大小関係 塩酸<酢酸<7<アンモニア水<水酸化ナトリウム水溶液
さらに、塩酸と酢酸について、酸の強弱を観察するためにマグネシウムリボンを入れ、気体の発生の激しさを比較します。また、気体の種類を調べるため、燃焼させます。
燃焼時の音と試験管が曇り水ができたことから、気体は水素であることが分かります。
今回の実験では、同じ濃度の強酸、弱酸、強塩基、弱塩基の水溶液4種類の組み合わせだったので、万能指示薬で判別できました。
例えば、強酸が2種類入っていれば、同じ実験結果となるため判別できません。(別の方法で判別します。)
金属と酸の組み合わせによっては、気体が発生しなかったり、水素以外の気体が発生することもあります。一般的な組み合わせでは、水素が発生することを理解しておきましょう。
校舎(村山公園より)
早朝、村山公園から球磨工を見ると・・・見えない。霧が深い。
しばらく、時間をおいて再び来て、見たところぼんやり見えました。
しばらく、時間をおいて再び来て、見たところぼんやり見えました。
朝の村山公園です。この霧の向こうに球磨工はあります。

見えますか?

もう少し、拡大してみました。

プレハブの撤去、ロータリーの工事も終わり、村山公園から外観を取りたかったのですが、霧にはばまれました。もっと天気の良い、昼間に撮影し直したいと思います。
化学基礎
ま、まずい。ネタがない!
こんなときは、我が身を切って対応しないと・・・ということで、化学基礎の実験です。
こんなときは、我が身を切って対応しないと・・・ということで、化学基礎の実験です。
1月、授業は酸と塩基(アルカリ)に入りました。実験は修学旅行から帰ってきてから進める予定です。
12月中旬は、化学式の復習を行いながら、金属銀をつくる実験を行いました。
実験11 金属樹と銀鏡反応
金属樹の実験はとても簡単です。
今回の実験では、無色の硝酸銀水溶液に、銅(銅線)を入れて、待つだけです。
実験の前に、銀イオン、硝酸イオンの化学式(イオン式)を書き、それらを組み合わせて、硝酸銀の化学式(組成式)を書きました。
実験は時間がかかりますが、しばらく待つと木の枝のような銀ができます。

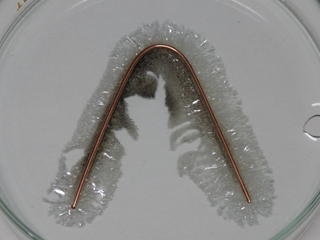


50分の授業時間では銀の成長は限られたものとなりますが、反応時間を長くすると、溶液中の銀イオンがどんどん金属銀に変化し、少しですが長く、太い銀になります。

写真では見えにくいですが、この反応で溶液は徐々に青色に変化します。青色の原因は、銅(II)イオンです。銀イオンが銀に変化し、銅が銅(II)イオンに変化するという、イオンと金属の入れ替えが起こります。
詳しい内容は、2月の授業(酸化還元反応)で学習します。
次は銀鏡反応です。
硝酸銀水溶液にアンモニア水を加えると、酸化銀ができ、褐色に濁ります。酸化銀は多量のアンモニア水には溶けてしまうので、ちょうど溶けるまでアンモニア水を加え、さらにブドウ糖(グルコース)水溶液を加え、温めると容器の内側に銀ができます。
実験の前に、アンモニア分子の電子式、構造式、分子式と形を書き、分子の復習をしました。
硝酸銀水溶液にアンモニア水を加えます。
酸化物を燃やさずにつくることができる点も不思議ではないですか?


アンモニア水をさらに加え、褐色の酸化銀が溶けたら、ブドウ糖水溶液を加えます。


温めると銀が出てきます。
無色の液体から銀ができる様子は感動です。


正しい説明ではありませんが、これまで学習した知識で説明するのであれば、溶けた酸化銀が還元されて銀になったと考えることができます。
ブドウ糖は血中にもある大切な糖類ですが、甘いという特徴だけでなく、相手を還元する性質も持っており、今回の実験では酸化銀を銀に還元する役割として加えられました。
暖房がなく、室温が氷点下になる日もある化学実験室ですが、生徒は暖かい教室での座学より、極寒の化学室での実験を求めております。
しっかり防寒対策をして、3学期も楽しく実験しましょう。
工事(ロータリー周辺)
冬休み中も校内の工事は引き続き行われています。
12月27日の様子
駐輪場前(仮設の事務室・校長室)ではアスファルト舗装が行われていました。


アスファルトフィニッシャ:アスファルト舗装のために使われる建設機械です。今回の工事で使用されているのは小型のミニアスファルトフィニッシャと思います。


ロードローラーはタンデム式とハンドガイド式の2台がありました。


12月30日の様子
駐輪場前は駐車場になりました。また駐車場とロータリーの段差も解消されました。


次の工事はどこかな?
行事予定表
球磨工公式インスタグラム
球磨工の情報を発信中!
リンクはこちらから
リンク
5
2
9
8
1
5
1
学校情報
〒868‐8515
熊本県人吉市城本町800番地
TEL 0966-22-4189
FAX 0966-22-5049
E-mail
kuma-th@pref.kumamoto.lg.jp
熊本県教育情報システム
登録機関
管理責任者 校長 坂本道彦
運用担当者 ホームページ係
リンク