球磨工ブログ
化学基礎
修学旅行、前期選抜などがあり、あまり授業が進んでいません。
でも、実験しない化学の授業はありえません。ということで、修学旅行後に実験しました。
でも、実験しない化学の授業はありえません。ということで、修学旅行後に実験しました。
実験12 酸・塩基の強弱
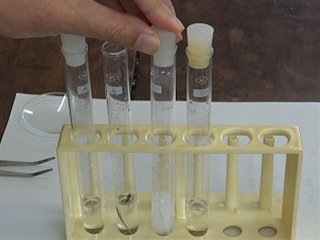
4本の試験管に入った塩酸、酢酸、水酸化ナトリウム水溶液、アンモニア水を判別する実験です。
まずは、においから。どの溶液も同じモル濃度ですが、十分に薄めてあるため、ほとんどの班が酢酸しか判断することができません。数名の生徒はアンモニア水を嗅ぎ分けました。よい鼻の持ち主です。
(経験上の話となりますが、酢酸はかなり希釈してもにおいが分かりますが、アンモニアはある程度希釈するとにおいが分かりにくくなります。)
次は、リトマス紙で酸性かアルカリ性かを判断します。
溶液をガラス棒につけ、赤と青のリトマス紙につけて変化を見ます。




次は万能指示薬で溶液のpHを調べます。pH7は中性、7より小さいと酸性、7より大きいと塩基性(アルカリ性)です。




pHを決定したことで、4種類の溶液が何であるか判断できました。
pHの大小関係 塩酸<酢酸<7<アンモニア水<水酸化ナトリウム水溶液
さらに、塩酸と酢酸について、酸の強弱を観察するためにマグネシウムリボンを入れ、気体の発生の激しさを比較します。また、気体の種類を調べるため、燃焼させます。
燃焼時の音と試験管が曇り水ができたことから、気体は水素であることが分かります。
今回の実験では、同じ濃度の強酸、弱酸、強塩基、弱塩基の水溶液4種類の組み合わせだったので、万能指示薬で判別できました。
例えば、強酸が2種類入っていれば、同じ実験結果となるため判別できません。(別の方法で判別します。)
金属と酸の組み合わせによっては、気体が発生しなかったり、水素以外の気体が発生することもあります。一般的な組み合わせでは、水素が発生することを理解しておきましょう。
行事予定表
球磨工公式インスタグラム
球磨工の情報を発信中!
リンクはこちらから
リンク
5
2
9
5
2
9
9
学校情報
〒868‐8515
熊本県人吉市城本町800番地
TEL 0966-22-4189
FAX 0966-22-5049
E-mail
kuma-th@pref.kumamoto.lg.jp
熊本県教育情報システム
登録機関
管理責任者 校長 坂本道彦
運用担当者 ホームページ係
リンク