球磨工ブログ
2014年3月の記事一覧
村山公園より
28日(金)、転退任式終了後、アヤメ公園、村山公園から管理棟を撮影してみました。
北門を出てアヤメ公園に来ました。管理棟と桜を同時に撮りたいのですが、なかなかよい撮影場所はありません。



さらに上の村山公園の展望台?まできました。



ピントをサクラに合わせたり、校舎に合わせたりしますが、よい写真は撮れません。


満足いく写真は撮れませんでしたが、帰り道に日本三鳴鳥の1つ、春告鳥(はるつげどり)、ウグイス(鶯、鴬)の声を聞き、撮影することができました。季節は、完全に春です。


化学基礎
今年度、最後の化学実験は電気分解となりました。
中学校でも学習・実験する水の電気分解です。
中学校でも学習・実験する水の電気分解です。
実験18 電気分解
まずは電気分解について学習し、実験に入りました。
水酸化ナトリウム水溶液の電気分解を行うための準備から始めます。
注射器でつくった電極に水溶液を満たし、ビーカーに立て、電源につないで電気分解を始めます。




電源を買うことも、電池を買うこともできないので、手回し発電機による電気分解です。一人一分、四人で四分間の電気分解を行いました。


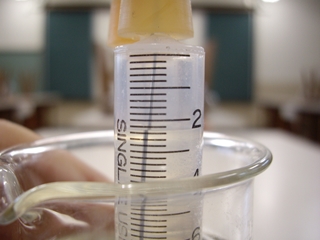
電源や電池の便利さやすばらしさを体感するだけではなく、生成物の確認も行います。陰極の水素が5.4+0.5=5.9mL、陽極の酸素が2.3+0.5=2.8mL(注射器の上部に目盛りのない0.5mLの空間があるため、目盛りの読み取り値に0.5mLを足しています。)
5.9÷2.8≒2.1 水素:酸素=2.1:1となり、学習する2:1に近い結果となりました。

次は電極を芯を出した鉛筆に変えて、水酸化ナトリウム水溶液を電気分解しますが、15秒~1分程度電気分解した後に電源を外し、電子メロディにつなぎ替えます。


電気分解も充電も、相手に電流を流すため同じことと考えることができます。水酸化ナトリウム水溶液の電気分解(充電)でできた電池は水素(と酸素)を燃料として働く燃料電池です。
化学基礎
今年度もクラスの授業時数に大きな差が生じ、少ないクラスは実験15で終了しました。
ほとんどのクラスは、実験17電池と実験18電気分解まで行うことができました。すべてのクラスの進度を合わせたいのですが、なかなかそろいません。
ほとんどのクラスは、実験17電池と実験18電気分解まで行うことができました。すべてのクラスの進度を合わせたいのですが、なかなかそろいません。
実験17 電池
まずは電池について学習し、実験に入りました。
・11円電池
2種類の金属と電解質水溶液で電池が構成されていることが分かるものです。この電池は、1円硬貨・10円硬貨・食塩水を染み込ませたティッシュペーパーでつくりました。0.5~0.6V程度の電圧の電池になります。


・人間電池
ティッシュペーパーを人間に変えても、電池になります。人間も2種類の金属を持てば電池になります。
食塩水をつけたティッシュペーパーでも、人間でも電圧は0.5~0.6Vとなり、使用する金属の種類で電圧が決定されることが分かります。
いい加減な電池に思えるかもしれませんが、直列つなぎにすると1.0~1.2Vとなることも確認できます。


・ダニエル電池
次は紙の箱をセパレーターにしたダニエル電池をつくり、LED・電子メロディ・モーターなどを使いました。








動画 ダニエル電池で電子メロディを鳴らす.wmv
動画 ダニエル電池でモーターを回す .wmv
ボルタ電池やダニエル電池は、負極に亜鉛、正極に銅が使われており、1.1Vの電圧になります。
つくられた電気エネルギーは光エネルギー、音エネルギー、運動エネルギーなどに変換することで、さらなる用途が生まれます。この世の中は電気なしでは成り立たなくなっています。電気を使うばかりでなく、もっと電気に興味・関心を持ちましょう。
屋上より
27日(木)晴れ、久しぶりに屋上に上ってきました。
管理棟の奥に正門前の桜並木が見えました。


セントラルパークと太陽光発電設備です。太陽光発電設備からは耳鳴りのような甲高い音が響いていましたが大丈夫でしょうか?


グラウンドではサッカー部、ハンドボール部、野球部などが練習に励んでいました。平成26年度の新入生も練習に参加しているようでしたので、人物が小さめの写真を掲載しておきます。




さらに各科の最上階や屋上に移動しました。電気科からは正門前のサクラが近く、きれいに見ることができました。




高いところからきれいにサクラの見える場所は無く、よい写真は撮れませんでした。
化学基礎
春休みはネタ不足。ブログの話題が理科に偏っている事はお許し下さい。
学年末考査が終わり、化学基礎は酸化還元反応に入りましたが、実験を中心に授業を進めています。
学年末考査が終わり、化学基礎は酸化還元反応に入りましたが、実験を中心に授業を進めています。
実験16 酸化還元反応2
テルミット反応を観察し、アルミニウムと鉄の金属のイオン化傾向の違いを理解します。また、アセチレンの発生と燃焼を行い、可燃物と空気(酸素)の混合比を考察します。
左はアルミニウムの粉末(3g)、右は酸化鉄(III)の粉末(8g)です。どちらも磁石につきません。


この2つをよく混ぜ合わせて、水で濡らしたろ紙に入れ、マグネシウムリボンを立てます。


準備ができたら点火です。


動画 テルミット反応.wmv
Fe2O3 + 2Al → Al2O3 + 2Fe
上記の反応が起こり、赤く溶けた鉄が得られます。鉄なので磁石につきます。


酸化鉄(III)の酸素がアルミニウムに移ったことから、アルミニウムの方が酸化されやすいということが分かり、金属のイオン化傾向の大きさが、Al>Feと決定できます。
カーバイドと水を反応させるとアセチレンを発生できます。
アルミ箔で包んだカーバイドを水に沈め、発生したアセチレンを試験管に水上置換しました。
アセチレンを集める量は、1本目100%、2本目50%、3,4本目12%です。(残りは空気になります。)


集め終わったら、1本目から火を着けていきます。


動画 アセチレン100%の燃焼.wmv
動画 アセチレン 50%の燃焼.wmv
動画 アセチレン 12%の燃焼.wmv
2C2H2 + 5O2 → 4CO2 + 2H2O
アセチレンの完全燃焼には多くの空気(酸素)が必要となります。空気が少ないと不完全燃焼しすすが出ます。動画の燃え方を見ると、少量の(12%)アセチレンの方が危険に思えませんか?
日本では、ロングレール化のためのレール溶接法として、テルミット溶接法の他、フラッシュ溶接法、ガス圧溶接法、エンクローズアーク溶接法が適用されています。テルミット反応は、線路づくりに欠かせない反応であることを知っておきましょう。
通常、ガス溶接と言えば、酸素アセチレン溶接のことを指します。アセチレンの取り扱いには十分に気をつけてください。
行事予定表
球磨工公式インスタグラム
球磨工の情報を発信中!
リンクはこちらから
リンク
5
3
6
8
6
0
0
学校情報
〒868‐8515
熊本県人吉市城本町800番地
TEL 0966-22-4189
FAX 0966-22-5049
E-mail
kuma-th@pref.kumamoto.lg.jp
熊本県教育情報システム
登録機関
管理責任者 校長 坂本道彦
運用担当者 ホームページ係
リンク