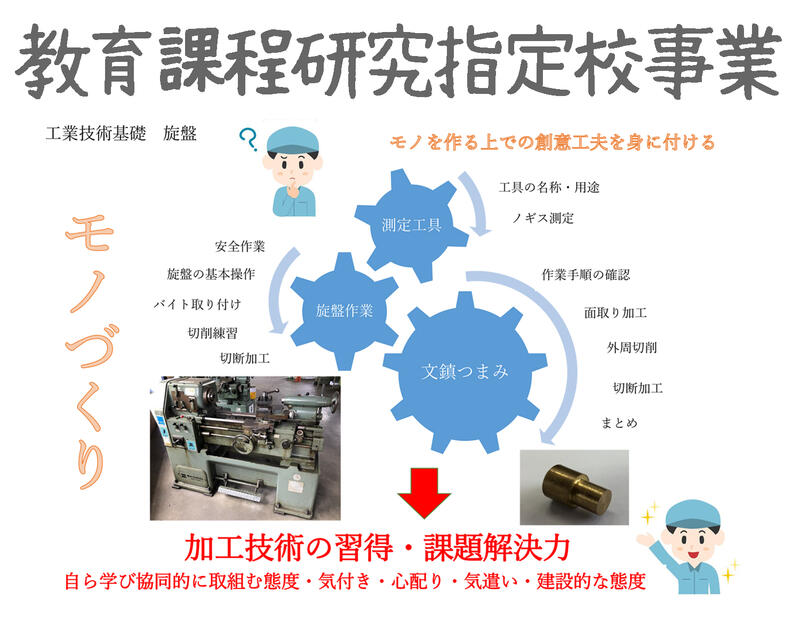
球磨工ブログ
化学基礎
春休みはネタ不足。ブログの話題が理科に偏っている事はお許し下さい。
学年末考査が終わり、化学基礎は酸化還元反応に入りましたが、実験を中心に授業を進めています。
学年末考査が終わり、化学基礎は酸化還元反応に入りましたが、実験を中心に授業を進めています。
実験16 酸化還元反応2
テルミット反応を観察し、アルミニウムと鉄の金属のイオン化傾向の違いを理解します。また、アセチレンの発生と燃焼を行い、可燃物と空気(酸素)の混合比を考察します。
左はアルミニウムの粉末(3g)、右は酸化鉄(III)の粉末(8g)です。どちらも磁石につきません。


この2つをよく混ぜ合わせて、水で濡らしたろ紙に入れ、マグネシウムリボンを立てます。


準備ができたら点火です。


動画 テルミット反応.wmv
Fe2O3 + 2Al → Al2O3 + 2Fe
上記の反応が起こり、赤く溶けた鉄が得られます。鉄なので磁石につきます。


酸化鉄(III)の酸素がアルミニウムに移ったことから、アルミニウムの方が酸化されやすいということが分かり、金属のイオン化傾向の大きさが、Al>Feと決定できます。
カーバイドと水を反応させるとアセチレンを発生できます。
アルミ箔で包んだカーバイドを水に沈め、発生したアセチレンを試験管に水上置換しました。
アセチレンを集める量は、1本目100%、2本目50%、3,4本目12%です。(残りは空気になります。)


集め終わったら、1本目から火を着けていきます。


動画 アセチレン100%の燃焼.wmv
動画 アセチレン 50%の燃焼.wmv
動画 アセチレン 12%の燃焼.wmv
2C2H2 + 5O2 → 4CO2 + 2H2O
アセチレンの完全燃焼には多くの空気(酸素)が必要となります。空気が少ないと不完全燃焼しすすが出ます。動画の燃え方を見ると、少量の(12%)アセチレンの方が危険に思えませんか?
日本では、ロングレール化のためのレール溶接法として、テルミット溶接法の他、フラッシュ溶接法、ガス圧溶接法、エンクローズアーク溶接法が適用されています。テルミット反応は、線路づくりに欠かせない反応であることを知っておきましょう。
通常、ガス溶接と言えば、酸素アセチレン溶接のことを指します。アセチレンの取り扱いには十分に気をつけてください。
行事予定表
球磨工公式インスタグラム
球磨工の情報を発信中!
リンクはこちらから
リンク
5
2
9
8
9
1
0
学校情報
〒868‐8515
熊本県人吉市城本町800番地
TEL 0966-22-4189
FAX 0966-22-5049
E-mail
kuma-th@pref.kumamoto.lg.jp
熊本県教育情報システム
登録機関
管理責任者 校長 坂本道彦
運用担当者 ホームページ係
リンク