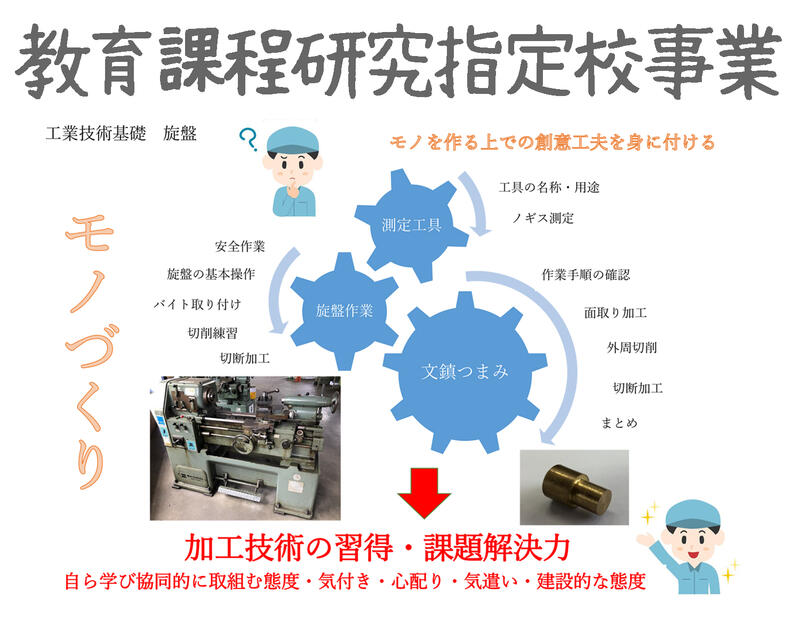
球磨工ブログ
カテゴリ:学校風景
化学基礎
学年末考査が終了し、授業の残りもわずかとなりました。
今週の実験は中和滴定でした。
今週の実験は中和滴定でした。
実験14 中和滴定
中和滴定は、酸や塩基の水溶液の濃度を決定する大切な実験です。
まずは、この実験に欠かせない、4つの器具の紹介から授業を始めました。
写真は、ホールピペットとメスフラスコです。ホールピペットは、一定の体積の溶液を取る器具で、メスフラスコは固体や液体を一定の体積に薄める器具です。


次は、コニカルビーカーとビュレットです。ビュレットから塩基の水溶液を滴下し、コニカルビーカー中の酸の水溶液を中和します。ビュレットは目盛りがあり、入れた溶液の体積を知ることができます。コニカルビーカーは普通のビーカーよりやや口が狭くなっていて、振り混ぜても液がこぼれにくい形になっています。


今回の実験では食酢中の酢酸の濃度を決定します。
まずは、ホールピペットとメスフラスコを使い、食酢を正確に10倍に薄めます。10倍に薄めた食酢を10mLホールピペットでコニカルビーカーに取ります。本実験では、ここまでの操作を教員側で行いました。
生徒はビュレットを操作して、中和を行い、滴下量から食酢中の酢酸の濃度を計算します。
10倍に薄めた食酢にフェノールフタレイン溶液を1滴加えます。次に、ビュレットの目盛りを読みます。最小目盛りの10分の1まで目分量で読み取るのは常識です。写真のビュレットの液面を、私は8.28mLと読み取りました。


ビュレットを操作して、慎重に0.100mol/L水酸化ナトリウム水溶液を滴下し、混ぜても淡い赤色が消えなくなったときが中和完了です。


中和が終わったときのビュレットの目盛りは、15.31mLと読み取りました。ちなみに数滴加えすぎただけで、溶液は赤くなりました。


15.31-8.28=7.03mLと滴下量を計算できました。このような中和を3回ほど繰り返し、滴下量の平均値を求めるのですが、ここでは、7.03mLを平均値として濃度の計算を行います。
「酸の価数×酸のモル濃度×酸の体積=塩基の価数×塩基のモル濃度×塩基の体積」の式を用いて、10倍に薄めた食酢のモル濃度を求めます。
1×酸のモル濃度×10=1×0.100×7.03 酸のモル濃度=0.0703mol/L
元の食酢のモル濃度は10倍になるので、0.703mol/L
1L=1000mLの食酢の密度を1g/mLとすると、1000mL×1g/mL=1000g
1Lの食酢に含まれる酢酸(分子量60)は、0.703mol×60g/mol=42.18g
(42.18g÷1000g)×100=4.218% 四捨五入して、4.22%と計算できました。
食酢のラベルには酸度4.2%とあるので、実験成功と言えると思います。

操作の難しい実験ですが、淡い赤色になり、きちんと中和できた班が多かったです。しかし、目盛りの読み取りミスや、計算ミスなどがあり、食酢中の酢酸の濃度がおかしい結果もありました。




行事予定表
球磨工公式インスタグラム
球磨工の情報を発信中!
リンクはこちらから
リンク
5
3
0
0
9
1
9
学校情報
〒868‐8515
熊本県人吉市城本町800番地
TEL 0966-22-4189
FAX 0966-22-5049
E-mail
kuma-th@pref.kumamoto.lg.jp
熊本県教育情報システム
登録機関
管理責任者 校長 坂本道彦
運用担当者 ホームページ係
リンク